Naukowcy z UW we współpracy z kolegami z Japonii prowadzą badania nad ryboprzełącznikami - segmentami RNA, które kontrolują produkcję białek w bakteriach. Ich badania mogą w przyszłości zaowocować nowymi strategiami walki z opornością mikroorganizmów na antybiotyki.
Jak informuje portal Uniwersytetu Warszawskiego, prof. Joanna Trylska oraz Piotr Chyży z Centrum Nowych Technologii UW oraz dr Marta Kulik z Wydziału Chemii tej samej uczelni, we współpracy z grupą prof. Yujiego Sugity z japońskiego instytutu badawczego Rikagaku Kenkyūjo (RIKEN), przeprowadzili symulacje dynamiki molekularnej dla układów ryboprzełącznik-antybiotyk. Wyniki swoich badań opisali w czasopiśmie „Proceedings of the National Academy of Sciences” (https://doi.org/10.1073/pnas.2317197121).
Wszystkie symulacje wykonali przy użyciu superkomputerów, w tym tych znajdujących się na Uniwersytecie Warszawskim.
Ryboprzełączniki to fragmenty mRNA (tzw. informacyjnego RNA), które znajdują się tuż przed częścią mRNA kodującą białko. Gdy zwiąże się z nimi odpowiednia cząsteczka, zwykle metabolit, wyłączają produkcję białka. Wpływanie na stan ryboprzełączników daje więc kontrolę nad produkcją konkretnych białek niezbędnych do życia komórki.
„Naturalnie występujące ryboprzełączniki mogą być celami dla nowych antybiotyków. Jeśli udałoby się zaprojektować cząsteczki, które blokowałyby określony ryboprzełącznik w bakteriach chorobotwórczych, mogłoby to prowadzić do unicestwienia tych komórek” - powiedziała cytowana w komunikacie prof. Joanna Trylska z Centrum Nowych Technologii UW.
Jednak ryboprzełączniki nie występują we wszystkich komórkach. Dlatego naukowcy zainteresowali się ich syntetycznymi odpowiednikami, które można by wprowadzić do mRNA i w ten sposób uzyskiwać kontrolę nad produkcją określonych białek.
Projektowanie syntetycznych ryboprzełączników jest jednak trudne, ponieważ wymaga przewidzenia, w jaki sposób zmieni się ich struktura po związaniu z kontrolującą je cząsteczką. „Sam fakt, że cząsteczka silnie wiąże się z ryboprzełącznikiem, nie oznacza, że zadziała on zgodnie z oczekiwaniami w komórkach” - wyjaśniła prof. Trylska.
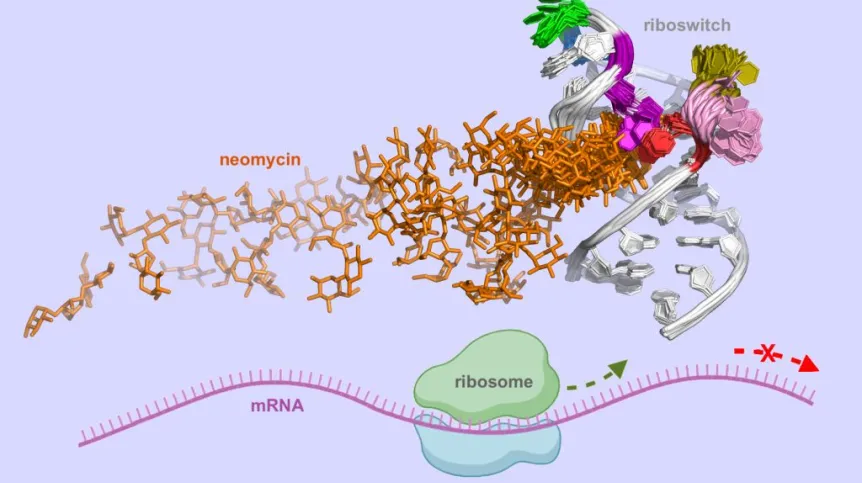
Naukowcy z UW i RIKEN zbadali syntetyczny ryboprzełącznik, który wiąże cząsteczkę antybiotyku neomycyny. Opracowali autorską metodę i własne narzędzia, które pozwoliły zrozumieć, jak wygląda cała ścieżka wiązania leku z tym segmentem mRNA. Otrzymane wyniki mogą pomóc w projektowaniu syntetycznych ryboprzełączników i cząsteczek, które kontrolują ich dynamikę i strukturę.
„Nasza praca pokazuje, jak kluczowe etapy oddziaływania neomycyny z ryboprzełącznikiem mogą być zoptymalizowane, aby zwiększyć jego skuteczność regulacyjną w komórkach - podkreśliła prof. Trylska. - Wyniki symulacji pokazują istotne różnice w ścieżce wiązania neomycyny do różnych sekwencji ryboprzełącznika oraz wskazują, jak te różnice wpływają na jego aktywność”.
Badacze mają nadzieję, że opracowana przez nich metodologia wspomoże proces projektowania nowych leków poprzez wybór najbardziej obiecujących związków do dalszych badań doświadczalnych. Chcieliby, aby ich wyniki pracy przyczyniły się w przyszłości do przyspieszenia projektowania fragmentów RNA jako potencjalnej strategii w walce z opornością mikroorganizmów na antybiotyki.(PAP)
Katarzyna Czechowicz
kap/ bar/
Fundacja PAP zezwala na bezpłatny przedruk artykułów z Serwisu Nauka w Polsce pod warunkiem mailowego poinformowania nas raz w miesiącu o fakcie korzystania z serwisu oraz podania źródła artykułu. W portalach i serwisach internetowych prosimy o zamieszczenie podlinkowanego adresu: Źródło: naukawpolsce.pl, a w czasopismach adnotacji: Źródło: Serwis Nauka w Polsce - naukawpolsce.pl. Powyższe zezwolenie nie dotyczy: informacji z kategorii "Świat" oraz wszelkich fotografii i materiałów wideo.